Artículos, Inseminación, Reproducción
Inseminación post-cervical única a tiempo fijo en nulíparas tras la inducción de la ovulación con Buserelina
13/08/2021 / ReproPig
Andrés Suárez-Usbeck1, Olga Mitjana1, M. Teresa Tejedor2, 3*, Cristina Bonastre1, Jorge Sistac3, Antonio Ubiergo4, María Victoria Falceto1
1 Departamento de Patología Animal IA2, Universidad de Zaragoza
2 Departamento de Anatomía, Embriología y Genética. CIBER. Universidad de Zaragoza
3 Granja Fabardo (Mazana Grupo Empresarial), 22480 Capella, Huesca
4 Semen Costean; CIA, 22312 Costean, Huesca
1. Introducción
El objetivo principal de la inseminación artificial (IA) es depositar el suficiente número de espermatozoides viables en el lugar apropiado del tracto genital femenino en el momento óptimo con respecto a la ovulación de la cerda. El protocolo de IA en las hembras nulíparas, recomienda dos o tres inseminaciones realizadas en el cuello del útero (IAC) cada 12-24 horas tras la detección del estro[1]. Las razones de la repetición de la IA radican en la breve viabilidad en el tracto reproductor tanto de los ovocitos como de los espermatozoides y la dificultad de predecir exactamente el momento de la ovulación durante el estro [3]. Como nueva alternativa de manejo reproductivo, en este estudio analizamos el uso de una única inseminación artificial post-cervical (IAPC) a tiempo fijo (IATF) en cerdas nulíparas.
El procedimiento de inseminación artificial post-cervical (IAPC) fue propuesto como una nueva técnica para depositar semen en el cuerpo uterino, como una alternativa a la IA cervical (IAC). El IAPC y el IAC se diferencian no sólo en el sitio de deposición del semen, sino también en la concentración de espermatozoides y el volumen de las dosis utilizadas para la IA[4, 5, 2]. La IAPC promueve un progreso genético eficiente, minimiza el reflujo de semen durante el proceso de inseminación y disminuye el tiempo para realizar el procedimiento de IA, sin reducir el tamaño de la camada ni la tasa de partos[4,6,7,2]. La idoneidad de IAPC en nulíparas se ha demostrado previamente con catéteres adaptados a la anatomía del aparato genital de una cerda joven[2, 8].
La IATF implica una sola dosis de semen aplicada dentro de un período de 0-24 h antes de la ovulación[9]. Una mejor comprensión de los mecanismos de regulación para el desarrollo folicular y la ovulación ha permitido nuevas perspectivas sobre el control de la ovulación en las nulíparas y, por tanto, para el desarrollo del IATF[10]. En las nulíparas, tanto la duración del estro como el intervalo entre el inicio del celo y la ovulación son muy variables; por lo tanto, es necesario controlar el momento de la ovulación[11, 1, 9].
Los análogos de la hormona liberadora de gonadotropina (GnRH), la hormona luteinizante (LH) y la gonadotropina coriónica humana (hCG) se han utilizado eficazmente para inducir la ovulación en cerdas destetadas y nulíparas, siempre con IAC[1, 12, 13]. Se han empleado varios agonistas de GnRH como inductores de la ovulación, como paso previo a diversas técnicas de IA[14, 15, 16, 17, 20, 21]. La buserelina con IAPC se ha utilizado en cerdas multíparas[18], mientras que la buserelina con doble IAC se ha aplicado en cerdas jóvenes[19]. Además, se obtuvieron buenos resultados reproductivos en nulíparas con un tratamiento con altrenogest seguido a las 115-120 h de la administración de buserelina, lo que permitió realizar IATF-IAC 30-33 h después[19]. Esta reducción del coste y la mano de obra de los protocolos hormonales podría facilitar el uso único de IATF en los protocolos rutinarios de IA en cerdas jóvenes.
El objetivo del presente estudio fue determinar el efecto de la buserelina (como protocolo de sincronización de la ovulación) y una sola IATF (usando la técnica IAPC) sobre los parámetros reproductivos y productivos cuando se usa en cerdas nulíparas de una granja comercial (grupo T). Los resultados de este protocolo se compararon con los del grupo control (grupo C) inseminado con IAPC doble durante el celo sin inducción hormonal de la ovulación.
2. Materiales y métodos
Este estudio se ha realizado en una granja ubicada cerca de Huesca (Capella). En el estudio se utilizaron un total de 482 cerdas jóvenes; estas nulíparas tenían 255-270 días de edad, pesaban 150±5 kg (SD), y tenían dos celos previamente detectados. Todos los animales pertenecían a una línea genética hiperprolífica (DanBred, DANBRED P/S, Herlev, Dinamarca).
Todas las nulíparas se sincronizaron con altrenogest (REGUMATE®, Merck & Co., Inc., Kenilworth, NJ, EE. UU.) administrado por vía oral e individual durante 18 días. Después de la IA, las nulíparas se alojaron en jaulas individuales (0,65±2 m) hasta que se realizó el diagnóstico de gestación (24 días después de la IA).
Las dosis de semen utilizadas en este estudio se obtuvieron de 49 verracos Pietrain diferentes, pertenecientes a un centro de inseminación, (Semen Costean; CIA, Costean, España). Se nos proporcionó solo eyaculados que cumplían con los requisitos mínimos (motilidad> 80% y anomalías totales <20%) y fueron idénticas en cada lote de inseminación para ambos grupos considerados en este estudio.
Después del tratamiento con altrenogest, las nulíparas se asignaron al azar a los grupos de control (C; n=244) y de tratamiento (T; n=238). La detección del estro se realizó dos veces al día (8:00 y 13:00). La duración del estro fue el intervalo (h) desde el establecimiento hasta la terminación del reflejo de inmovilidad. Cuando no se presentaron signos de celo, las nulíparas se consideraron en anestro y se retiraron del experimento.
En el grupo C, 240 nulíparas fueron inseminadas por primera vez 8 h después del inicio del estro y nuevamente 12 h después, durante el período de estro. Ambas inseminaciones se realizaron mediante la técnica IAPC.
Las nulíparas del grupo T recibieron 10 µg de buserelina intramuscular (Porceptal®, MSD, Salamanca, España) 120 h después de la última dosis de altrenogest. La detección del estro se realizó entre 30 y 33 h más tarde y 226 nulíparas fueron inseminadas en el grupo T.
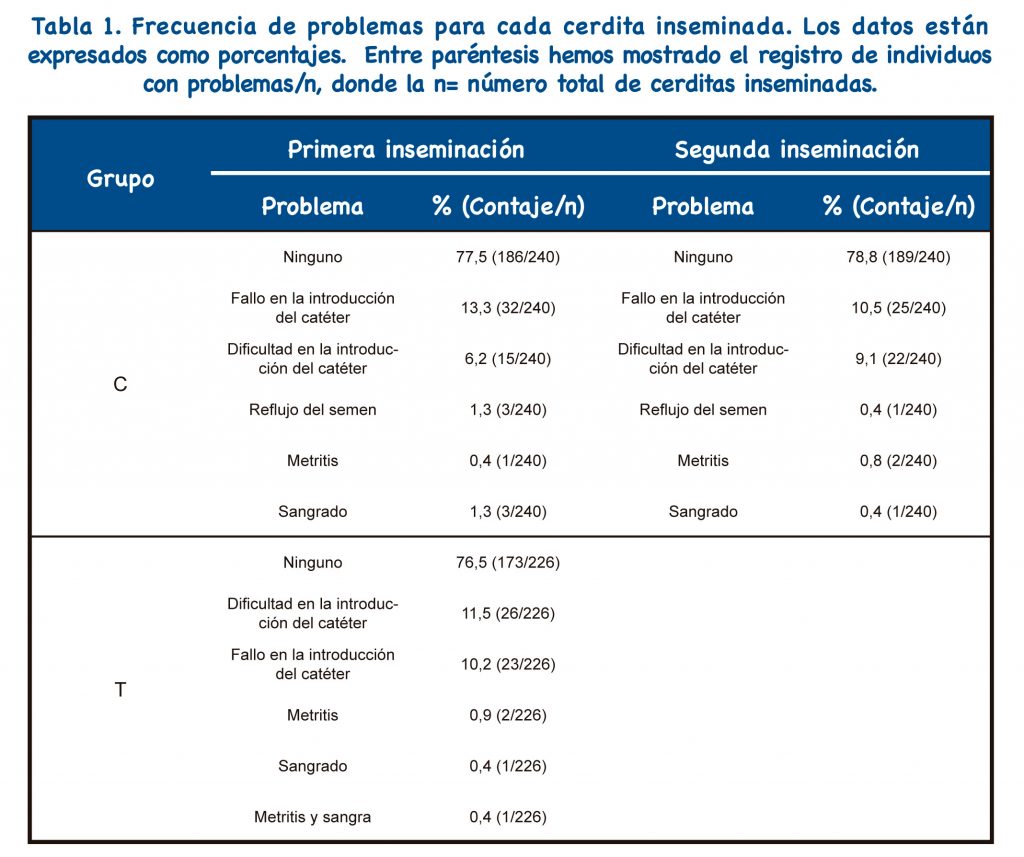
Tanto en el grupo C como en el grupo T, la IAPC se realizó de la misma manera ; sin presencia de verraco, utilizando una sonda IAPC específica para nulíparas (MAGAPLUS N®, Magapor, Ejea de los Caballeros, España) y la concentración de la dosis fue siempre de 1,5×109 espermatozoides por 60 ml. Cuando la sonda IAPC no pudo pasar a través del cuello uterino, las nulíparas de cualquiera de los dos grupos se inseminaron a IAC y se retiraron del estudio; a partir de entonces, sólo se consideraron 194 y 203 cerdas jóvenes para los grupos C y T, respectivamente.
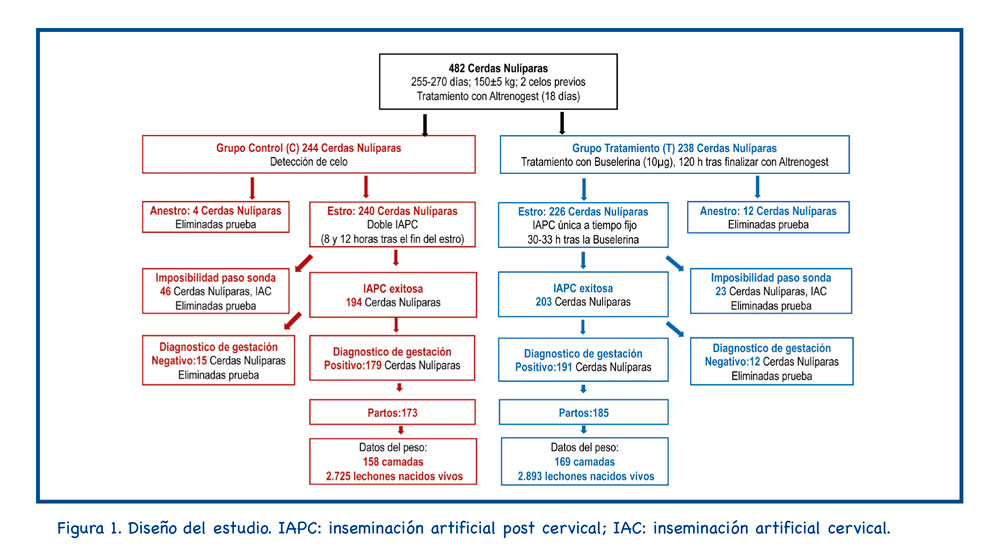
3. Resultados
La Tabla 1 muestra los resultados de IA para cada cerdita inseminada. Los grupos C y T difirieron significativamente en la proporción de nulíparas que mostraron un paso exitoso de la sonda postcervical (194/240: 80,8% frente a 203/226: 89,8% en los grupos C y T, respectivamente, p=0,006).
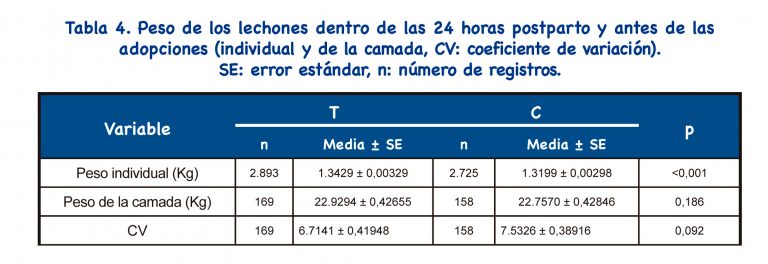
Se encontraron valores significativamente mayores para el peso individual de los lechones para el grupo T (p<0,001), pero no se encontraron diferencias significativas para el peso de la camada (p>0,050). No se detectaron diferencias significativas para coeficiente de variación (p=0,092); sin embargo, los percentiles 25 y 50 fueron más bajos en el grupo T (1,45 y 5,77, respectivamente) que en el grupo C (3,55 y 7,27, respectivamente), lo que apunta a una tendencia para camadas más homogéneas en el grupo tratado.
4. Discusión
Hasta donde sabemos, este es el primer estudio sobre el uso de IAPC con una dosis seminal única a tiempo fijo en nulíparas. El principal objetivo de la aplicación de la técnica IAPC en nulíparas es la inserción exitosa de una cánula a través del cuello uterino, obstaculizado por el pequeño tamaño del tracto reproductivo.
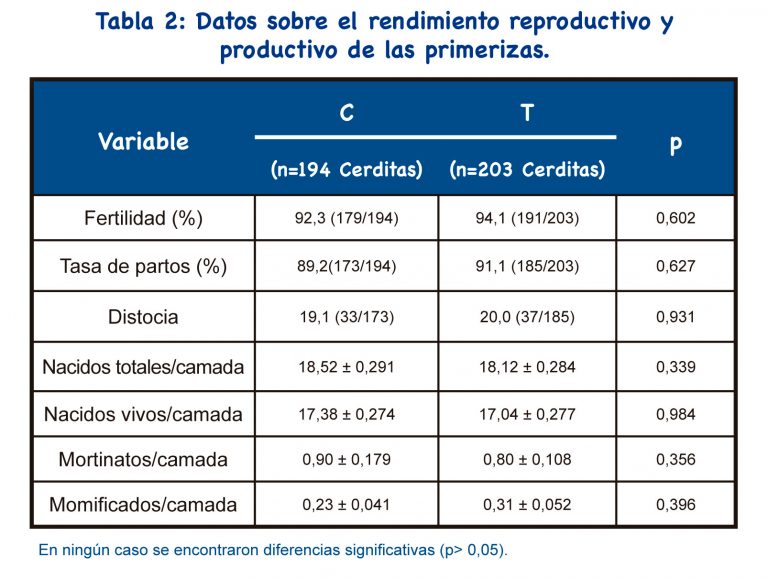
Por otro lado, aunque se utilizó IAPC en ambos grupos, cada nulípara se inseminó dos veces en el grupo C y solo una vez en el grupo T ; por lo tanto, la probabilidad de que la sonda pase sin éxito disminuyó en el grupo T, como se esperaba.
Se han utilizado varios análogos de GnRH en cerdas y nulíparas como inductores de la ovulación, y se han estudiado sus efectos sobre los parámetros reproductivos. Solo unos pocos estudios utilizaron el análogo de GnRH buserelina en protocolos IATF para nulíparas. La fertilidad, la tasa de partos y el tamaño de la camada fueron similares a nuestros resultados de un único protocolo IATF-IAPC con buserelina.
La duración del estro fue más corta en las nulíparas tratadas con buserelina (p<0,001).
El protocolo propuesto, buserelina más IATF-IAPC única, tiene como objetivo la sincronización de la reproducción mediante la inducción de la ovulación y el uso eficiente de dosis de semen con la técnica IAPC. Por lo tanto, se esperaría agrupar los partos en un período corto. Las ventajas de todas las cerdas pariendo juntas incluyen una mayor eficiencia en el trabajo de la sala de partos debido a manejo de adopciones más fácil, mejor supervisión del parto y procesamiento eficiente de las camadas[15,22].
Los protocolos IATF que incluyen el uso de análogos de GnRH tienen como objetivo mejorar el peso de los lechones al nacer (peso individual y de la camada), así como la homogeneidad del peso de la camada[23]. Nuestro protocolo resultó en un aumento del peso individual al nacer, pero no se encontraron diferencias para el peso de la camada y la homogeneidad de la camada.
Por otro lado, no se indujo el parto en esta granja y no se detectaron diferencias significativas entre los grupos para la duración de la gestación; la duración de la gestación no explicaría la diferencia detectada en el peso al nacer. Por lo tanto, se puede suponer que el tratamiento hormonal aplicado no empeorará el peso del lechón recién nacido. No se encontraron diferencias significativas entre los grupos para el total de lechones nacidos/camada y, por lo tanto, el peso individual ligeramente aumentado al nacer en el grupo T no se reflejó en el peso de la camada. La homogeneidad de la camada fue alta tanto en el grupo T como en el C; la explicación podría ser un excelente manejo en la maternidad.
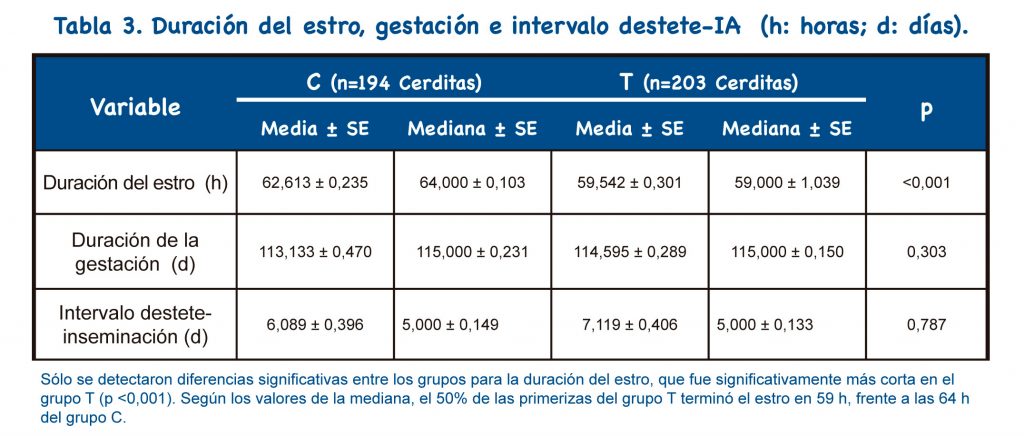
El protocolo propuesto implica el uso de un tratamiento adicional (buserelina) con respecto al protocolo habitual (doble IAPC). Sin embargo, dado que sólo se necesita una inseminación, se reduce el costo de semen, material y personal; por lo tanto, el protocolo propuesto representa una reducción del 36% en el coste del protocolo habitual. Además, el protocolo propuesto muestra otras ventajas: Sincronizar la ovulación y reducir el número de inseminaciones permite una mejor organización del trabajo.
También se hace posible una mayor agrupación de partos, lo que permite un mejor cuidado de las madres y lechones recién nacidos. El uso de una sola dosis de semen permite que los verracos seleccionados sean probados en un mayor número de hembras en menos tiempo, por lo que sus pruebas de progenie se pueden completar más rápidamente. De esta manera, se logra una mayor velocidad en la difusión de la mejora genética.
5. Conclusiones
El presente estudio propone, como novedad, la combinación en hembras nulíparas de la inseminación única a tiempo fijo tras la aplicación de Buserelina con la técnica de inseminación artificial post-cervical. Sólo se encontró un pequeño porcentaje de fallos en la penetración de la sonda post-cervical (10,2%; 23/226). La frecuencia de reflujo de semen, metritis y sangrado también fue pequeña (frecuencia global: 14,8%; 30/203). No hubo impactos significativos en los parámetros reproductivos: fertilidad, prolificidad, duración de la gestación y del intervalo destete-IA.
Se detectó disminución significativa en la duración del estro, además, se encontró un aumento significativo en el peso individual al nacer. Según nuestros resultados, se puede recomendar el uso de una única IATF-IAPC con buserelina en nulíparas. El uso de esta nueva técnica combinada reduce tanto las dosis seminales como el número de IA; por tanto, se consigue una importante optimización de las dosis de semen y verracos. De esta forma, cada nulípara solo necesita 1.500 x 106 espermatozoides (una dosis) para quedar preñada, frente a los 6.000 x 106 espermatozoides (dos dosis) necesarios con la técnica habitual.
6. Bibliografía
- Kirkwood, R. N.; Kauffold, J. (2015). Advances in breeding management and use of ovulation induction for fixed‐time AI. Reprod. Domest. Anim. 2015, 50, 85-89. 10.1111/rda.12524
- Suárez-Usbeck, A.; Mitjana, O.; Tejedor, M. T.; Bonastre, C.; Moll, D.; Coll, J., Ballester, C.; Falceto, M.V.(2019). Post-cervical compared with cervical insemination in gilts: Reproductive variable assessments. Anim. Reprod. Sci. 2019, 211, 106207. 10.1016/j.anireprosci.2019.106207
- Belstra, B. A.; Flowers, W. L.; See, M. T. (2004). Factors affecting temporal relationships between estrus and ovulation in commercial sow farms. Anim. Reprod. Sci. 2004, 84, 377-394. 10.1016/j.anireprosci.2004.02.005
- Wilson, M. E. Differences in mating between a boar, traditional artificial insemination, and post cervical insemination. In: 12th London Swine Conference Proceedings. A time for change. London, UK, Ontario, Canada, 2012 pp. 45-53. https://www.cabdirect.org/cabdirect/abstract/20133231146
- Hernández Caravaca, I. Productive output of post-cervical insemination in porcine: study of sperm selection in the female genital tract through backflow análisis. Phd Thesis, Universidad de Murcia, Spain, 2015. http://hdl.handle.net/10201/45947
- Bortolozzo, F. P.; Menegat, M. B.; Mellagi, A. P. G;, Bernardi, M. L.; Wentz, I. (2015). New artificial insemination technologies for swine. Reprod. Domest. Anim. 2015, 50, 80-84. 10.1111/rda.12544
- García-Vázquez, F. A.; Mellagi, A. P. G.; Ulguim, R. R.; Hernández-Caravaca, I.; Llamas-López, P. J.; Bortolozzo, F. P. Post-cervical artificial insemination in porcine: the technique that came to stay. Theriogenology 2019, 129, 37-45. 10.1016/j.theriogenology.2019.02.004
- Will, K. J. ; Silveira, D. F.; Musskopf, M. N.; Mellagi, A. P. G.; Bortolozzo, F. P.; Kummer, R.; da Rosa Ulguim, R. Reproductive performance in gilts following applications of different insemination doses and techniques. Theriogenology 2021, 160, 26-32. 10.1016/j.theriogenology.2020.10.030
- Baroncello, E.; Bernardi, M. L.; Kummer, A. D.; Wentz, I.; Bortolozzo, F. P. (2017). Fixed‐time post‐cervical artificial insemination in weaned sows following buserelin use combined with/without eCG. Reprod. Domest. Anim. 2017, 52, 76-82. 10.1111/rda.12805
- De Rensis, F.; Kirkwood, R. N. Control of estrus and ovulation: Fertility to timed insemination of gilts and sows. Theriogenology 2016, 86, 1460-1466. 10.1016/j.theriogenology.2016.04.089
- Brüssow, K. P.; Schneider, F.; Kanitz, W.; Ratky, J.; Kauffold, J.; Wähner, M. Studies on fixed-time ovulation induction in the pig. Nottingham University Press: Nottingham, UK, 2009; pp 187-198.
- Bennett-Steward, K; Aramini, J.; Pelland, C; Friendship, R. Equine chorionic gonadotrophin and porcine luteinizing hormone to shorten and synchronize the wean-to-breed interval among parity-one and parity-two sows. J. Swine Health Prod. 2008, 16, 182-187. https://www.aasv.org/shap/issues/v16n4/v16n4p182.htm
- Cassar, G.; Kirkwood, R. N.; Poljak, Z.; Bennett-Steward, K.; Friendship, R. M. Effect of single or double insemination on fertility of sows bred at an induced estrus and ovulation. J. Swine Health Prod., 2005, 13, 254-258. https://www.aasv.org/shap/issues/v13n5/v13n5p254
- Fontana, D. L; Ulguim, R. R.; Sbardella, P. E.; Bernardi, M. L.; Wentz, I.; Bortolozzo, F. P. Fixed-time post-cervical artificial insemination in sows receiving porcine luteinising hormone at oestrus onset. Anim. Reprod. Sci. 2014, 144, 109-114. 10.1016/j.anireprosci.2013.12.003
- Ulguim, R. R.; Fontana, D. L.; Rampi, J. Z.; Bernardi, M. L;, Wentz, I.; Bortolozzo, F. P. (2014). Use of Porcine Luteinizing Hormone at Oestrous Onset in a Protocol for Fixed‐Time Artificial Insemination in Gilts. Reprod. Domest. Anim. 2014, 49, 756-760. 10.1111/rda.12362
- Zak, L. J.; Patterson, J.; Hancock, J.; Hockley, D.; Foxcroft, G. R. Benefits of synchronizing ovulation with porcine luteinizing hormone in a fixed-time insemination protocol in weaned multiparous sows. J. Swine Health Prod. 2010, 18, 125-131.
- Fries, H. C. C.; Souza, L. P.; Faccin, J. E. G.; Reckziegel, M. V.; Hernig, L.; Marimon, B. T.; Bernardi, M.L.; Wentz, I; Bortolozzo, F. P. (2018). Induction and synchronization of ovulation in sows using a Gonadotropin-releasing Hormone Analog (Lecirelin). Anim. Reprod. 2018, 7, 362-366. https://www.animal-reproduction.org/journal/animreprod/article/5b5a6069f7783717068b474d
- Driancourt, M. A.; Cox, P.; Rubion, S.; Harnois-Milon, G. ; Kemp, B. ; Soede, N. M. Induction of an LH surge and ovulation by buserelin (as Receptal) allows breeding of weaned sows with a single fixed-time insemination. Theriogenology 2013, 80, 391-399. 10.1016/j.theriogenology.2013.05.002
- Martinat-Botté, F. ; Venturi, E. ; Guillouet, P. ; Driancourt, M. A. ; Terqui, M. Induction and synchronization of ovulations of nulliparous and multiparous sows with an injection of gonadotropin-releasing hormone agonist (Receptal). Theriogenology 2010, 73, 332-342. 10.1016/j.theriogenology.2009.09.017
- Knox, R.V.; Willenburg, K.L.; Rodriguez‐Zas, S.L., Greger, D.L., Hafs, H.D., Swanson, M.E. Synchronization of ovulation and fertility in weaned sows treated with intravaginal triptorelin is influenced by timing of administration and follicle size. Theriogenology 2011, 75, 308– 319.10.1016/j.theriogenology.2010.09.001
- Knox, R. V.; Taibl, J. N.; Breen, S. M.; Swanson, M. E.; Webel, S. K. Effects of altering the dose and timing of triptorelin when given as an intravaginal gel for advancing and synchronizing ovulation in weaned sows. Theriogenology 2014, 82, 379-386. 10.1016/j.theriogenology.2014.04.020
- Quirino, M.; Pinheiro, A. R. A.; Santos, J. T. D.; da Rosa Ulguim, R. D. R.; Mellagi, A. P. G.; Bortolozzo, F. P. Reproductive performance of fixed-time artificial insemination in swine and factors for the technology success. Cienc. Rural 2019, 49, e20180712 http://dx.doi.org/10.1590/0103-8478cr20180712
- Falceto, M.V. Essential guides on swine health and production. Artificial insemination and hormone management in the sow. Servet editorial. Grupo Asis Biomedia, S.L. : Zaragoza, Spain, 2018, pp 88.

ReproPig
También te puede interesar
- Vacunación de cerdas hiperprolíficas: ¿podemos mejorar la inmunización de sus lechones frente a E. coli?

- Sincronización del estro con altrenogest, clave en el manejo reproductivo

- Una correcta gestión de las nulíparas, clave para conseguir los objetivos productivos



